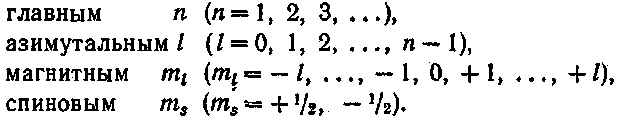
Распределение электронов в атоме по энергетическим уровням
Каждый электрон в атоме движется в первом приближении в центрально-симметричном некулоновском поле. Состояние электрона в этом случае определяется тремя квантовыми числами: n и m, физический смысл которых был выяснен.
Таким образом, состояние каждого электрона в атоме характеризуется четырьмя квантовыми числами:
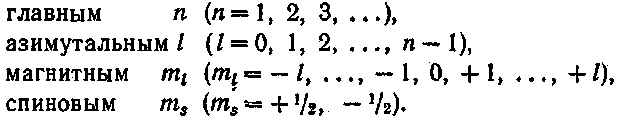
Энергия состояния зависит в основном от чисел п и д. Кроме того, имеется слабая зависимость энергии от чисел ml и тs поскольку их значения связаны с взаимной ориентацией моментов, от которой зависит величина взаимодействия между орбитальным и собственным магнитными моментами электрона. За некоторыми исключениями, энергия состояния сильнее возрастает с увеличением числа n, чем с увеличением l. Поэтому, как правило, состояние с большим «обладает, независимо от значения l, большей энергией,
В нормальном (невозбужденном) состоянии атома электроны должны располагаться на самых низких доступных для них энергетических уровнях. Поэтому,казалось бы, в любом атоме в нормальном состоянии все электроны должны находиться в состоянии Is (я — 1, / = 0), а основные термы всех атомов должны быть типа 5-термов (L — Q). Опыт, однако, показывает, что это не так.
Объяснение наблюдаемых типов термов заключается в следующем. Согласно одному из законов квантовой механики, называемому принципом Паули1), в одном и том же атоме (или в какой-либо квантовой системе) не может быть двух электронов, обладающих одинаковой совокупностью четырех квантовых чисел. Иными словами, в одном и том же состоянии не могут находиться одновременно два электрона.
Данному п соответствуют, как мы уже знаем, п2 состояний, отличающихся значениями / и т\ (см. § 69). Квантовое число ms может принимать два значения: ±7г. Поэтому в состояниях с данным значением п могут находиться в атоме не более 2/г2 электронов:
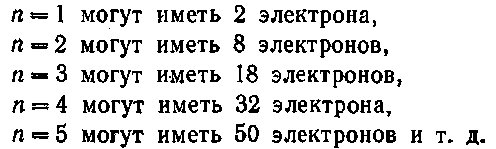
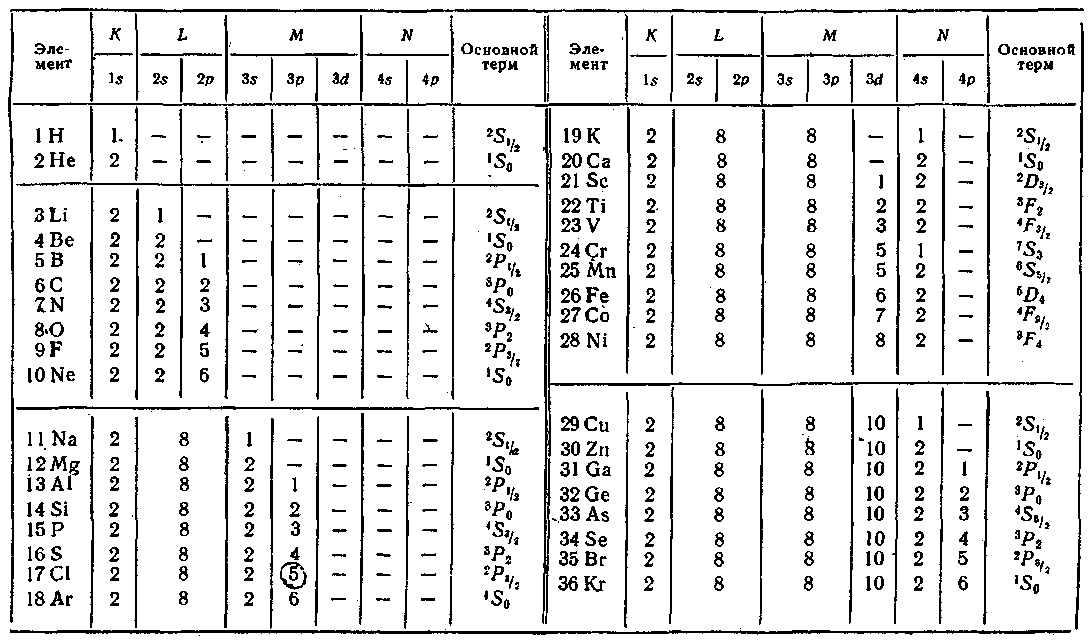
Совокупность электронов, имеющих одинаковые п и /, образует оболс-чку. Совокупность оболочек с одинаковым п образует группу или слой. В соответствии с значением п слоям дают обозначения, заимствованные из спектроскопии рентгеновских лучей:
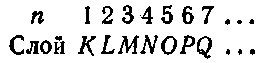
Подразделение возможных состояний электрона в атоме на оболочки и слои показано в табл. 5, в которой вместо обозначений та = ±7г применены символы: fj. Оболочки, как указано в таблице, могут обозначаться двумя способами (например, L\ либо 2s).
Для полностью заполненной оболочки характерно равенство нулю суммарного орбитального и спинового моментов (L = 0; S = 0). Следовательно, момент количества движения такой оболочки равен нулю (У = 0.) Убедимся в этом на примере З^-оболочки. Спины всех десяти электронов, входящих в эту оболочку, попарно компенсируют друг друга, вследствие чего S = 0. Квантовое число проекции результирующего орбитального момента Ml этой оболочки на ось z имеет единственное значение ![]() . Следовательно, L также равно нулю.
. Следовательно, L также равно нулю.
Таким образом, при определении L и S атома заполненные оболочки можно не принимать во внимание.
§ 77. Периодическая система элементов Менделеева
Принцип Паули дает объяснение периодической повторяемости свойств атомов. Проследим построение периодической системы элементов Д. И. Менделеева. Начнем с атома с Z = 1, имеющего один электрон. Каждый последующий атом будем получать, увеличивая заряд ядра предыдущего атома на единицу и добавляя к нему один электрон, который мы будем

помещать в доступное ему согласно принципу Паули состояние с наименьшей энергией,
В атоме водорода имеется в основном состоянии один Is электрон с произвольной ориентацией спина. Его квантовые числа: ![]()
![]() . Соответственно основной терм водородного атома имеет вид 25у2.
. Соответственно основной терм водородного атома имеет вид 25у2.
Если заряд ядра атома водорода увеличить на единицу и добавить к нему еще один электрон, получится атом гелия. Оба электрона в этом атоме могут находиться в /(-слое, но с антипараллельной ориентацией спинов.
Так называемая электронная конфигурация амома может быть записана как Is2 (два ls-электрона). Основным термом будет ![]() (L = О, S = = 0,7 = 0).
(L = О, S = = 0,7 = 0).
На атоме гелия заканчивается заполнение слоя К. Третий электрон атома лития может занять лишь уровень 2s (рис, 218). Получается электронная конфигурация ls22s. Основное состояние характеризуется L = О, 5 = 7г- Поэтому основным термом, как и у водорода, будет 2Sy2. Третий электрон атома лития, занимая более высокий энергетический уровень, чем остальные два электрона, оказывается слабее, чем они, связанным с ядром атома, В результате он определяет оптические и химические свойства атома.
У четвертого элемента, бериллия, полностью заполняется оболочка 2s. У последующих шести элементов (В, С, N, О, F и Ne) происходит заполнение электронами оболочки 2/7, в результате чего неон имеет полностью заполненные слои К (двумя электронами) и L (восемью электронами), образующие устойчивую систему, подобную системе гелия, чем обусловливаются специфические свойства инертных газов.
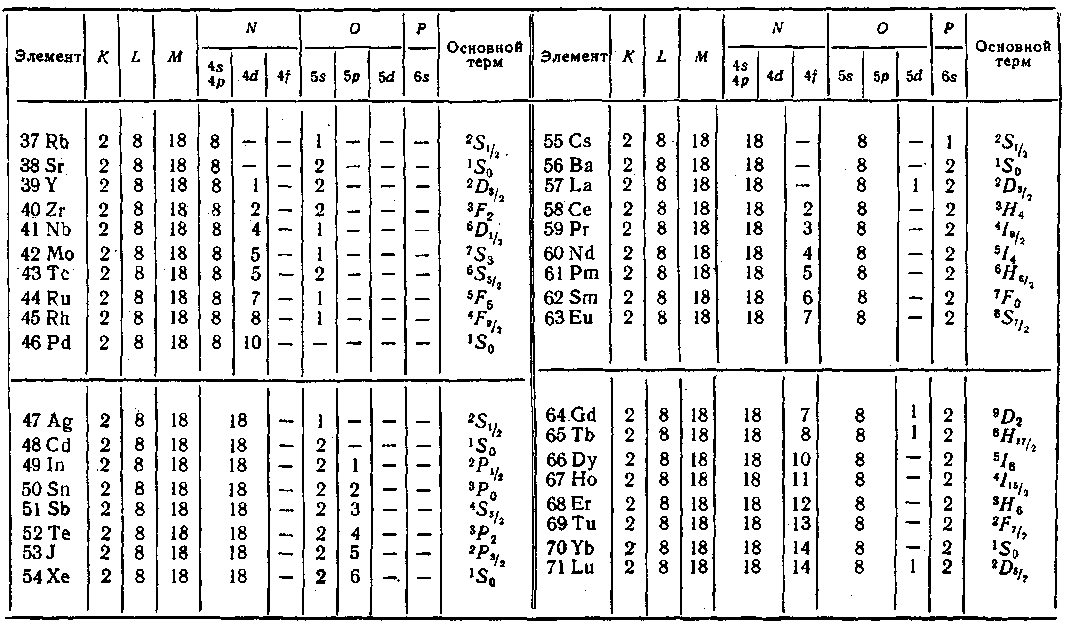
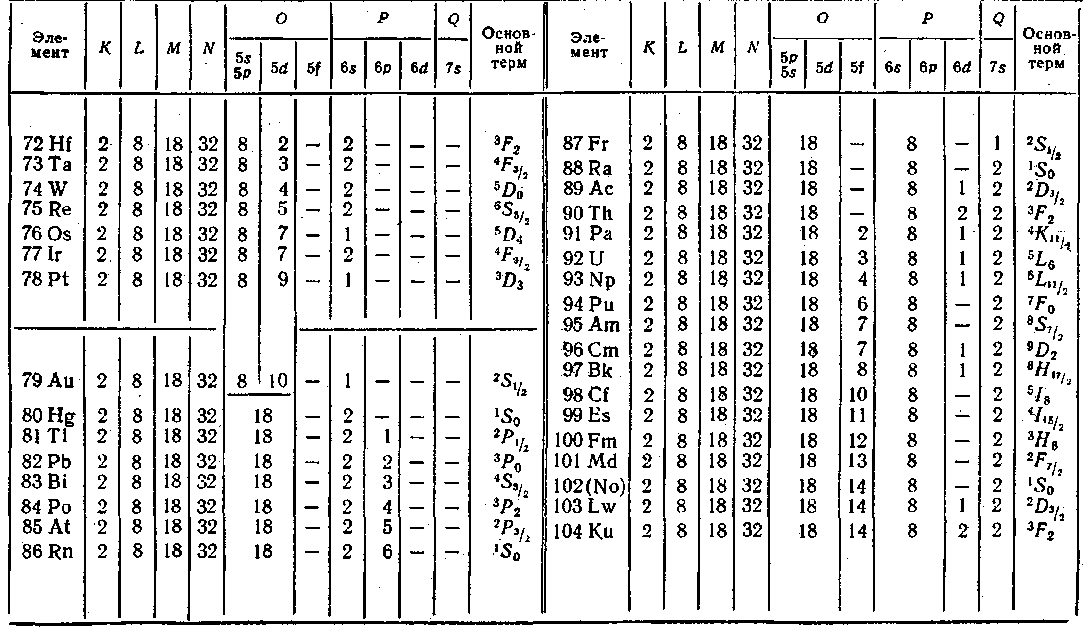
Процесс застройки электронных оболочек у элементов периодической системы наглядно представлен в табл, 6. Одиннадцатый элемент, натрий, имеет, кроме заполненных слоев К и L, один электрон в оболочке 3s. Электронная конфигурация имеет вид: ![]() . Основным
. Основным
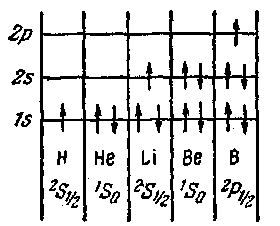
Рис. 218.
термом будет 2Sy2. Электрон 35 связан с ядром слабее других и является валентным или оптическим электроном. В связи с этим химические и оптические свойства натрия подобны свойствам лития.
Основное состояние оптического электрона в атоме натрия характеризуется значением п — 3. Этим и объясняется то обстоятельство, что на схеме* уровней атома натрия (см. рис. 204) основной уровень помечен цифрой 3. Попутно отметим, что атом цезия имеет в основном состоянии электронную конфигурацию
Следовательно, его оптический электрон имеет в основном состоянии п — 6. В соответствии с этим помечены уровни на рис. 205.
У следующих за натрием элементов нормально заполняются оболочки 35 и Зр. Оболочка 3d при данной общей конфигурации оказывается энергетически выше оболочки 45, в связи с чем при незавершенном в целом заполнении слоя М начинается заполнение слоя N. Оболочка Ар лежит уже выше, чем 3d, так что после 45 заполняется оболочка 3d.
С аналогичными отступлениями от обычной последовательности, повторяющимися время от времени, осуществляется застройка электронных уровней всех атомов. При этом периодически повторяются сходные электронные конфигурации (например, 15, 25, 35 и т. д.) сверх полностью заполненных оболочек или слоев, чем обусловливается периодическая повторяемость химических и оптических свойств атомов.
Как видно из табл. 6, заполнение оболочки 4f, которая может содержать 14 электронов, начинается лишь после того, как полностью заполняются оболочки 55, 5/) и 6s. Квантовомеханический расчет показывает, что в d- и особенно в /-состоянии электрон находится гораздо ближе к ядру, чем в 5- и ^-состояниях. Следовательно, 4f-электроны располагаются во внутренних областях атома. Поэтому у элементов с номера 58 по 71, называемых редкими землями или лантанидами, внешняя оболочка (б52) оказывается одинаковой. В связи с этим лантани-ды весьма близки по своим химическим свойствам, которые определяются внешними (валентными) электронами. Аналогичную группу химически родственных элементов
образуют актиниды (атомные номера с 90 по 103), у которых заполняется 5/-оболочка при неизменной внешней оболочке 7s2.
Изложенные в § 74 правила сложения моментов позволяют вычислить значения квантовых чисел L, S и /, возможные при заданной электронной конфигурации. Так, например, при конфигурации пр2 (два электрона с главным квантовым числом п и I = \) возможными значениями L будут 0, 1, 2 (1\ = 1, /2 = 1), а квантовое число 5 может иметь значения 0 и 1 (si = 7г, s2 ■= 7г)-В соответствии с этим, казалось бы, при конфигурации пр2 возможны термы: ![]() . Однако при
. Однако при
установлении вида термов, возможных при данной кон: фигурации эквивалентных электронов (т. е. электронов с одинаковыми я и 1), необходимо считаться с принципом Паули — для эквивалентных электронов возможны лишь такие термы, для которых значения хотя бы одного квантового числа (т, или ms) обоих электронов не совпадают1). Этому требованию, очевидно, не удовлетворяет, например, терм 3Z). Действительно, L — 2 означает, что орбитальные моменты электронов «параллельны», следовательно, значения trti у этих электронов будут совпадать. ^Аналогично S = 1 означает, что спины электронов 'также «параллельны», вследствие чего совпадают и значения ms. В итоге все четыре квантовых числа (п, /, rrii и ms) у обоих электронов оказываются одинаковыми, что противоречит принципу Паули. Таким образом, терм 3D в системе из двух эквивалентных электронов реализоваться не может.
Чтобы установить возможные термы, согласующиеся с принципом Паули, используют следующий прием: в столбцах таблицы, помеченных значениями nti отдельно, взятого электрона, проставляют в виде стрелок значения ms (стрелка вверх означает тв = -fV2, стрелка вниз— ms = —У2 (см. табл. 7, составленную для двух эквивалентных р-электронов). В таблице содержатся все до* пустимые принципом-Паули сочетания значений т\ и тл обоих электронов. В тех случаях, когда обе стрелки попадают в один столбец (это означает, что mi обоих электронов одинаково), они направлены в противоположные ороны (ms должны быть разными). В следующих столбцах таблицы проставлены соответствующие данному сочетанию значения квантовых чисел ML и MS} равные алгебраической сумме чисел mt и ms. Совокупность допустимых значений ML и Ms позволяет установить допустимые сочетания значений L и 5. Одна из таких совокупностей, помеченная буквой Л в последнем столбце таблицы, соответствует сочетанию L = 2, S = О, т. е. терму lDt вторая совокупность, помеченная буквой Б, соответствует L = 1, S = 1, т. е. терму гР и, наконец» совокупность, помеченная буквой С, соответствует L — О, S = =-О, т. е. терму *5. Таким образом, из указанных выше шести формально возможных термов не противоречат принципу Паули только три: l5, 3Я, lD, причем терм 3Я является триплетом — онтюдразделяется на компоненты: 3Я2, 3Ri> 3Ro- Возникает вопрос, какой из этих термов соответствует основному состоянию, т. е. состоянию с наименьшей энергией. Ответ на этот вопрос дают два эмпирических правила Хунда.
1. Из термов, даваемых эквивалентными электронами, наименьшей энергии соответствует терм с наиболь-
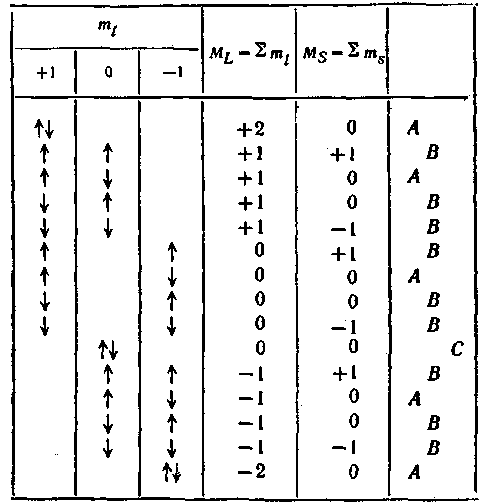
Таблица 7
шим возможным значением 5 (т. е. терм с наибольшей мультиплетностыо) и с наибольшим возможным при таком S значением I.
2. Мультиплеты, образованные эквивалентными электронами, являются правильными (это значит, что с увеличением / возрастает энергия сбстояния), если заполнено не более половины оболочки, и обращенными (с увеличением / энергия убывает), если заполнено больше половины оболочки.
Из второго правила Хунда следует, что в случае, когда заполнено не более половины оболочки, наименьшей энергией обладает компонента мультиплета с / = |L — 5|, в протианом случае — компонента с / *= L + S.
В рассмотренном нами примере двух р-электронов наименьшей энергией обладает терм 3Р (у него наибольшее 5), а из, трех его компонент наименьшей энер-; гией обладает 3Ro> так как оболочка заполнена только на одну треть (в р:оболочке может находиться 6 электронов).
Отметим, что результирующие моменты заполненных оболочек равны нулю. Поэтому при определении с помощью правила' Хунда основного терма, атома следует рассматривать только незаполненную оболочку. Конфигурацией пр2 сверх заполненных оболочек обладают углерод (С), кремний (Si), германий (Ge), олово (Sn) и свинец (РЬ). У всех этих элементов основным является терм 3Ro (см. табл. 6).