Вторичная структура - это пространственное расположение полипептидной цепочки в виде α-спирали или β-складчатости безотносительно к типам боковых радикалов и их конформации. Она стабилизирована водородными связями, которые замыкаются между пептидными, амидными (-N-H) и карбонидными (-C=O)группами, т.е. входят в пептидную единицу, и дисульфидными мостиками между остатками цистеина
Полинг и Кори предложили модель вторичной структуры белка в виде левозакрученной α-спирали, в которой водородные связи замыкаются между каждой первой и четвертой аминокислотой, что позволяет сохранять нативную структуру белка, осуществление им простейших функций, защищать от разрушения. На один виток спирали приходится 3,6 аминокислотных остатка, шаг спирали составляет 0,54 нм. В образовании водородных связей принимают участие все пептидные группы, что обеспечивает максимальную стабильность, снижает гидрофильность и увеличивает гидрофобность белковой молекулы. Альфа-спираль образуется самопроизвольно и является наиболее устойчивой конформацией, отвечающей минимуму свободной энергии (Рис. 4.).
Полинг и Кори предложили и другую упорядоченную структуру - складчатый β- слой. В отличие от конденсированной α-спирали β- слои почти полностью вытянуты и могут располагаться как параллельно:
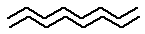 , так и антипараллельно
, так и антипараллельно 
В стабилизации данных структур также принимают участие дисульфидные мостики и водородные связи.
Супервторичная структура - это более высокий уровень организации белковой молекулы,представленный ансамблем взаимодействующих между собой вторичных структур:
- α-спираль - два антипараллельных участка, взаимодействуют гидрофобными комплементарными поверхностями (по принципу впадина-выступ) αсα
- Сверхспирализация α-спирали
- βхβ - два параллельных участка β-цепи
- β-зигзаг