Термолабильность ферментов объясняется тем, что температура, с одной стороны, воздействует на белковую часть фермента, приводя при слишком высоких значениях к денатурации белка и снижению каталитической функции, а с другой стороны, оказывает влияние на скорость реакции образования фермент-субстратного комплекса и на все последующие этапы преобразования субстрата, что ведет к усилению катализа.
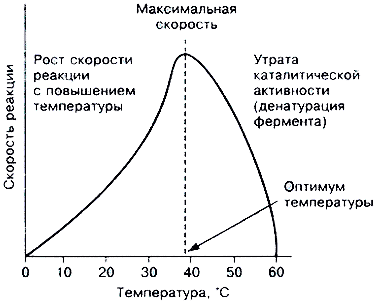
Рис.4.Зависимость скорости ферментативной реакции от температуры
Зависимость каталитической активности фермента от температуры выражается типичной кривой. До некоторого значения температуры (в среднем до 5О°С) каталитическая активность растет, причем на каждые 10°С примерно в 2 раза повышается скорость преобразования субстрата. В то же время постепенно возрастает количество инактивированного фермента за счет денатурации его белковой части. При температуре выше 50°С денатурация ферментного белка резко усиливается и, хотя скорость реакций преобразования субстрата продолжает расти, активность фермента, выражающаяся количеством превращенного субстрата, падает.
Детальные исследования роста активности ферментов с повышением температуры, проведенные в последнее время, показали более сложный характер этой зависимости, чем указано выше: во многих случаях она не отвечает правилу удвоения активности на каждые 10°С в основном из-за постепенно нарастающих конформационных изменений в молекуле фермента.
Температура, при которой каталитическая активность фермента максимальна, называется его температурным оптимумом.
Температурный оптимум для различных ферментов неодинаков. В общем для ферментов животного происхождения он лежит между 40 и 50°С, а растительного - между 50 и 60°С. Однако есть ферменты с более высоким температурным оптимумом, например, у папаина (фермент растительного происхождения, ускоряющий гидролиз белка) оптимум находится при 8О°С. В то же время у каталазы (фермент, ускоряющий распад Н2О2 до Н2О и О2) оптимальная температура действия находится между 0 и -10°С, а при более высоких температурах происходит энергичное окисление фермента и его инактивация.