Ферменты, обладающие относительной специфичностью, ускоряют реакции, характерные для определенных типов химических связей в молекулах различных веществ одного класса. Например, пищеварительный фермент пепсин ускоряет гидролиз пептидных связей, образованных при участии циклических аминокислот, в любых белках; липаза - гидролиз сложноэфирных связей глицеридов, образованных любыми жирными кислотами.
По образному выражению, нередко употребляемому в биохимической литературе, фермент подходит к субстрату, как ключ к замку. Это знаменитое правило было сформулировано Э. Фишером в 1894 г. исходя из того, что специфичность действия фермента предопределяется строгим соответствием геометрической структуры субстрата и активного центра фермента (Рис. 7.).
В 50-е годы нашего столетия это статическое представление было заменено гипотезой Д. Кошланда об индуцированном соответствии субстрата и фермента. Сущность ее сводится к тому, что пространственное соответствие структуры субстрата и активного центра фермента создается в момент их взаимодействия друг с другом, что может быть выряжено формулой "перчатка - рука". При этом в субстрате уже деформируются некоторые валентные связи и он, таким образом, подготавливается к дальнейшему каталитическому видоизменению, а в молекуле фермента происходят конформационные перестройки. Гипотеза Кошланда, основанная на допущении гибкости активного центра фермента, удовлетворительно объясняла активирование и ингибирование действия ферментов и регуляцию их активности при воздействии различных факторов. В частности, конформационные перестройки в ферменте в процессе изменения его активности Кошланд сравнивал с колебаниями паутины, когда в нее попала добыча (субстрат), подчеркивая этим крайнюю лабильность структуры фермента в процессе каталитического акта (Рис. 7.):
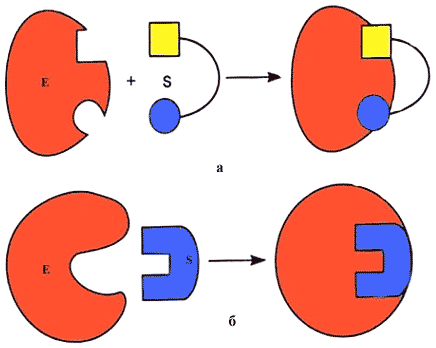
Рис.7. Модели взаимодействия фермента с субстратом: а) - модель "жесткой матрицы" по Э.Фишеру; б) - модель "перчатка - рука" по Д.Кошланду.
В настоящее время гипотеза Кошланда постепенно вытесняется гипотезой топохимического соответствия. Сохраняя основные положения гипотезы взаимоиндуцированной настройки субстрата и фермента, она фиксирует внимание на том, что специфичность действия ферментов объясняется в первую очередь узнаванием той части субстрата, которая не изменяется при катализе. Между этой частью субстрата и субстратным центром фермента возникают многочисленные точечные гидрофобные взаимодействия и водородные связи.